Viêm khớp dạng thấp (VKDT) là một bệnh tự miễn mạn tính, trong đó hệ thống miễn dịch của cơ thể nhận nhầm các mô của chính mình – đặc biệt là màng hoạt dịch – là “kẻ lạ”, từ đó tạo ra phản ứng viêm kéo dài, dẫn đến phá hủy sụn khớp, xương dưới sụn và biến dạng khớp. VKDT không chỉ gây ảnh hưởng nghiêm trọng đến khả năng vận động mà còn có thể gây tổn thương ngoài khớp như tim, phổi, mắt và hệ thần kinh trung ương.
Bệnh chiếm tỷ lệ từ 0,5–1% dân số toàn cầu, với nữ giới mắc bệnh nhiều gấp 2–3 lần nam giới. Bệnh thường khởi phát ở độ tuổi trung niên (30–50 tuổi), nhưng cũng có thể gặp ở người trẻ và thậm chí cả trẻ em. VKDT là nguyên nhân hàng đầu dẫn đến tàn phế sớm nếu không được phát hiện và điều trị kịp thời. Trong quá khứ, các phương pháp điều trị truyền thống như NSAIDs, corticoid và DMARDs cổ điển chỉ giúp cải thiện triệu chứng phần nào, ít có khả năng ngăn chặn hoàn toàn tiến triển bệnh.
Tuy nhiên, hai thập kỷ gần đây đã chứng kiến sự bùng nổ trong nghiên cứu và ứng dụng các liệu pháp điều trị mới, đặc biệt là thuốc sinh học (biologics), thuốc nhắm trúng đích (targeted synthetic DMARDs – tsDMARDs) và chiến lược điều trị cá thể hóa. Những bước tiến này không chỉ cải thiện đáng kể chất lượng sống của bệnh nhân mà còn mang lại hy vọng lui bệnh hoàn toàn – điều từng được cho là bất khả thi.
Tổng quan về viêm khớp dạng thấp
Sinh lý bệnh và cơ chế bệnh sinh
Yếu tố khởi phát bệnh
Yếu tố di truyền:
- Các nghiên cứu di truyền đã xác định rằng HLA-DRB1 – đặc biệt là các alen mang trình tự “shared epitope” – liên quan mạnh mẽ đến nguy cơ mắc VKDT.
- Những alen như HLA-DRB104:01, DRB104:04, DRB1*01:01 thường gặp ở bệnh nhân VKDT có anti-CCP dương tính.
- Các gen không thuộc HLA như PTPN22, STAT4, TRAF1/C5, CTLA4 cũng có liên quan đến sự điều hòa đáp ứng miễn dịch và làm tăng nguy cơ mắc bệnh.
Yếu tố môi trường:
- Hút thuốc lá là yếu tố nguy cơ được xác nhận mạnh nhất, đặc biệt ở những người mang gen HLA-DR “shared epitope”, làm tăng chuyển hóa arginin thành citrullin – một bước quan trọng hình thành antigen mới kích thích đáp ứng miễn dịch.
- Các yếu tố khác: nhiễm virus (EBV, Parvovirus B19), vi khuẩn (Proteus, Porphyromonas gingivalis), tiếp xúc bụi silica, mất cân bằng hệ vi sinh đường ruột, giới tính (nữ > nam), thay đổi hormone, stress kéo dài…
Hoạt hóa miễn dịch và hình thành tự kháng thể
Trong giai đoạn khởi phát, các tế bào trình diện kháng nguyên như tế bào tua (dendritic cells) phát hiện các antigen bất thường (citrullinated peptides), sau đó trình diện cho tế bào T tại các hạch lympho.
Tế bào T CD4+ (đặc biệt là dòng Th1, Th17) được hoạt hóa và tiết ra các cytokine như IFN-γ, IL-17, TNF-α, kích hoạt các tế bào miễn dịch khác như đại thực bào và tế bào B.
Tế bào B được hoạt hóa sẽ sản xuất ra các tự kháng thể:
- Yếu tố thấp khớp (Rheumatoid Factor – RF): IgM chống lại phần Fc của IgG.
- Anti-CCP (kháng thể kháng peptide citrullin hóa vòng): có độ nhạy và đặc hiệu cao cho VKDT.
Các tự kháng thể này tạo thành phức hợp miễn dịch lắng đọng tại màng hoạt dịch, tiếp tục hoạt hóa bổ thể và gây tổn thương mô.
Vai trò của cytokine và viêm mạn tính tại khớp
Tại màng hoạt dịch, sự hiện diện của các tế bào miễn dịch (T, B, đại thực bào, bạch cầu trung tính) và phức hợp miễn dịch gây giải phóng cytokine tiền viêm, trong đó có:
- TNF-α: là cytokine chủ đạo, kích hoạt đại thực bào, tế bào nội mô, gây biểu hiện phân tử kết dính (ICAM, VCAM), tăng sinh mạch máu (angiogenesis) và tăng tính thấm thành mạch.
- IL-1β: kích thích tạo enzyme tiêu hủy sụn như MMPs (matrix metalloproteinases) và tăng hoạt động hủy xương.
- IL-6: kích thích tế bào gan sản xuất CRP, thúc đẩy phân hóa tế bào B thành tương bào và tham gia vào đáp ứng toàn thân (thiếu máu, sốt…).
- IL-17: được sản xuất bởi tế bào Th17, làm tăng hoạt hóa đại thực bào, tăng biểu hiện RANKL trên tế bào xương – từ đó tăng hủy xương.
Tăng sinh mô hoạt dịch và hình thành pannus
Dưới tác động viêm kéo dài, mô hoạt dịch trở nên quá sản và tăng sinh bất thường tạo thành khối mô dạng u gọi là pannus.
Pannus xâm lấn sụn khớp và xương dưới sụn, tiết enzyme tiêu hủy (MMPs, cathepsin K), gây mòn sụn, bào mòn xương, dẫn đến dính khớp, biến dạng khớp không hồi phục.
Đồng thời, các tế bào hoạt dịch sản xuất VEGF (vascular endothelial growth factor), làm tăng sinh mạch máu tân tạo, duy trì quá trình viêm mạn tính.
Tổn thương ngoài khớp
VKDT là bệnh hệ thống, do đó các cytokine và phức hợp miễn dịch có thể ảnh hưởng đến các cơ quan ngoài khớp:
- Tim: viêm màng ngoài tim, tăng nguy cơ xơ vữa mạch máu và bệnh mạch vành.
- Phổi: viêm màng phổi, xơ phổi kẽ, nốt phổi dạng thấp.
- Mắt: viêm kết mạc, viêm củng mạc.
- Huyết học: thiếu máu mạn tính, hội chứng Felty (giảm bạch cầu + lách to).
- Da: nốt thấp dưới da, viêm mạch dạng thấp.
Diễn tiến lâm sàng
VKDT thường tiến triển chậm rãi qua các giai đoạn: tiền lâm sàng → khớp nhỏ đối xứng → đa khớp → biến dạng và dính khớp.
60–70% bệnh nhân nếu không được điều trị tích cực sẽ tiến triển đến mất chức năng vận động sau 10–15 năm.
Các yếu tố tiên lượng nặng: anti-CCP cao, RF cao, HLA-DR4 (+), tổn thương khớp sớm trên X-quang, viêm nhiều khớp lớn.
Triệu chứng lâm sàng
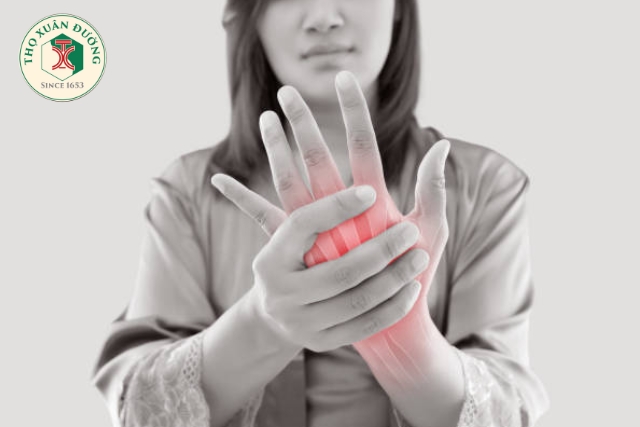
Triệu chứng đặc trưng là đau, sưng và cứng khớp buổi sáng kéo dài trên 1 giờ, thường khởi phát từ các khớp nhỏ như cổ tay, bàn tay, bàn chân.
Biểu hiện viêm đối xứng là dấu hiệu đặc trưng. Bệnh tiến triển dần, gây biến dạng khớp, mất chức năng vận động nếu không được điều trị kịp thời. Ngoài tổn thương khớp, VKDT còn gây biến chứng ngoài khớp như viêm màng phổi, viêm màng ngoài tim, nốt thấp dưới da, viêm mạch máu và các biểu hiện thần kinh trung ương.
Tiêu chuẩn chẩn đoán
Tiêu chuẩn ACR/EULAR 2010 là công cụ chẩn đoán chính xác được sử dụng rộng rãi hiện nay. Hệ thống này dựa trên 4 yếu tố: số lượng khớp viêm, kết quả huyết thanh học (RF, anti-CCP), tình trạng viêm (CRP, ESR) và thời gian biểu hiện triệu chứng. Tổng điểm ≥6/10 cho thấy khả năng chẩn đoán VKDT rất cao. Ngoài ra, các phương tiện hình ảnh như X-quang, siêu âm Doppler và MRI cũng giúp phát hiện sớm tổn thương khớp và đánh giá hoạt tính bệnh.
Điều trị kinh điển và hạn chế
Mục tiêu điều trị
Điều trị VKDT hiện đại không chỉ dừng lại ở việc giảm đau, kháng viêm mà còn nhắm đến các mục tiêu xa hơn như kiểm soát hoạt tính viêm, ngăn tiến triển bệnh, bảo tồn chức năng khớp và cải thiện chất lượng sống. Mục tiêu lý tưởng là đạt lui bệnh (remission), hoặc ít nhất là bệnh hoạt động ở mức thấp.
Các nhóm thuốc kinh điển
NSAIDs (ibuprofen, diclofenac): giúp giảm đau, chống viêm nhưng không có tác dụng làm thay đổi diễn tiến bệnh (non-disease-modifying).
Corticosteroid: như prednisone giúp kiểm soát nhanh triệu chứng viêm, đặc biệt trong đợt cấp, nhưng việc sử dụng kéo dài có thể dẫn đến loãng xương, tăng huyết áp, đái tháo đường…
DMARDs cổ điển (csDMARDs):
- Methotrexate (MTX) là thuốc nền tảng với hiệu quả vượt trội và chi phí thấp, thường là lựa chọn đầu tay.
- Sulfasalazine, leflunomide, hydroxychloroquine thường dùng kết hợp với MTX để tăng hiệu quả.
Hạn chế của điều trị cổ điển
Dù đã cải thiện tiên lượng bệnh đáng kể, phương pháp điều trị truyền thống vẫn còn những hạn chế lớn. Khoảng 30–40% bệnh nhân không đáp ứng đầy đủ với csDMARDs. Ngoài ra, thời gian tác dụng chậm (thường từ 6–12 tuần), tác dụng phụ trên gan, tủy xương và hệ tiêu hóa là rào cản trong điều trị lâu dài.
Cách mạng trong điều trị: Thuốc sinh học
Giới thiệu về thuốc sinh học
Thuốc sinh học (biologic DMARDs – bDMARDs) là các protein tái tổ hợp được sản xuất bằng công nghệ sinh học, có khả năng nhắm vào những mục tiêu phân tử cụ thể như cytokine, thụ thể hoặc tế bào miễn dịch. bDMARDs giúp kiểm soát viêm mạnh mẽ và làm chậm đáng kể tiến triển phá hủy khớp.
Các nhóm thuốc sinh học chính
Kháng TNF-α
TNF-α là một cytokine chủ lực trong quá trình viêm của VKDT. Các thuốc kháng TNF bao gồm:
- Etanercept (dạng hòa tan thụ thể TNF)
- Infliximab, Adalimumab, Golimumab, Certolizumab (kháng thể đơn dòng)
Những thuốc này giúp giảm nhanh triệu chứng, cải thiện chức năng vận động và ngăn ngừa tổn thương khớp. Tuy nhiên, cần tầm soát lao, viêm gan trước khi điều trị do nguy cơ tái hoạt các nhiễm trùng tiềm ẩn.
Kháng IL-6: Tocilizumab, Sarilumab
IL-6 có vai trò kích thích gan sản xuất CRP và hoạt hóa tế bào B. Tocilizumab – kháng thể chống lại IL-6 receptor – được chứng minh có hiệu quả cao, đặc biệt trong trường hợp kháng MTX hoặc không dung nạp TNF-α inhibitors.
Ức chế tế bào T: Abatacept
Abatacept ngăn sự kích hoạt tế bào T bằng cách ức chế tương tác CD28–CD80/86 thông qua CTLA-4Ig. Thuốc hiệu quả trong trường hợp kháng sinh học nhóm TNF.
Ức chế tế bào B: Rituximab
Rituximab là kháng thể đơn dòng chống CD20, gây tiêu diệt tế bào B. Phù hợp với bệnh nhân RF (+), anti-CCP (+), và không đáp ứng các thuốc khác.
Ưu điểm và thách thức
bDMARDs mang lại hiệu quả cao nhưng đòi hỏi giám sát chặt chẽ do nguy cơ nhiễm trùng, tái hoạt lao, viêm gan B và chi phí điều trị lớn. Cần có chiến lược cá thể hóa để tối ưu hiệu quả điều trị và hạn chế biến chứng.
Thuốc nhắm trúng đích (tsDMARDs)
Cơ chế tác động
Khác với thuốc sinh học, JAK inhibitors (JAKi) là các phân tử nhỏ đường uống, ức chế hoạt động của enzyme Janus kinase – thành phần thiết yếu trong đường truyền tín hiệu của các cytokine như IL-6, IFN-γ… Nhờ đó, JAKi chặn phản ứng viêm từ trong tế bào.
Các thuốc đã được phê duyệt
- Tofacitinib: ức chế JAK1/3
- Baricitinib: ức chế JAK1/2
- Upadacitinib, Filgotinib: chọn lọc JAK1
Các thuốc này được FDA và EMA phê duyệt cho VKDT mức độ trung bình – nặng, không đáp ứng hoặc không dung nạp csDMARDs/bDMARDs.
Hiệu quả lâm sàng
JAKi cho thấy hiệu quả vượt trội hoặc tương đương bDMARDs trong cải thiện DAS28, CDAI và chức năng khớp. Đặc biệt, thuốc có tác dụng nhanh, dạng uống tiện lợi, phù hợp với người không thích tiêm chích.
Tác dụng phụ và theo dõi
JAKi có thể gây nhiễm trùng, tăng lipid máu, nguy cơ huyết khối tĩnh mạch sâu. Các báo cáo gần đây cho thấy người trên 65 tuổi và có bệnh tim mạch nên được cân nhắc kỹ khi dùng nhóm này. Cần xét nghiệm định kỳ công thức máu, lipid, chức năng gan và thận.
Xu hướng cá thể hóa trong điều trị VKDT
Cá thể hóa điều trị nghĩa là thiết kế liệu trình riêng biệt cho từng bệnh nhân dựa vào yếu tố di truyền, chỉ dấu sinh học, bệnh đi kèm, đáp ứng thuốc và nguyện vọng người bệnh. Mục tiêu là tối ưu hóa hiệu quả điều trị và giảm tác dụng phụ.
Công cụ hỗ trợ
Biomarkers: RF, anti-CCP, CRP, IL-6, TNF-α.
Gen: HLA-DR4 liên quan tiên lượng xấu.
Chỉ số hoạt tính bệnh: DAS28, SDAI, CDAI…
Phân tầng nguy cơ: để xác định cần dùng csDMARDs đơn thuần hay kết hợp bDMARDs/tsDMARDs.
Mô hình Treat-to-Target (T2T)
Chiến lược T2T nghĩa là theo dõi sát hoạt tính bệnh mỗi 1–3 tháng, điều chỉnh thuốc linh hoạt để đạt mục tiêu lui bệnh (remission). Đây là nền tảng quan trọng cho cá thể hóa và giúp tăng đáng kể tỷ lệ kiểm soát bệnh.
Phối hợp điều trị và hỗ trợ khác
Bên cạnh thuốc, các phương pháp hỗ trợ góp phần quan trọng vào hiệu quả lâu dài:
Vật lý trị liệu: giúp duy trì tầm vận động khớp, tăng sức mạnh cơ, ngăn co rút khớp.
Tâm lý trị liệu: cần thiết vì bệnh mạn tính thường kèm theo lo âu, trầm cảm.
Dinh dưỡng và lối sống: chế độ ăn giàu omega-3, giảm đường, giảm cân nếu béo phì. Bỏ hút thuốc và hạn chế rượu để giảm nguy cơ bệnh tim mạch liên quan.
Triển vọng tương lai
VKDT từng là “án tử vận động” nhưng hiện nay đã có thể kiểm soát và lui bệnh nhờ những bước tiến vượt bậc trong điều trị. Sự ra đời của thuốc sinh học, JAK inhibitors và xu hướng điều trị cá thể hóa đang từng bước biến VKDT thành bệnh mạn tính có thể kiểm soát tốt.
Tương lai của điều trị VKDT sẽ tiếp tục phát triển theo hướng kết hợp trí tuệ nhân tạo, phân tích dữ liệu lớn và phát hiện sớm yếu tố di truyền – từ đó đưa ra phác đồ điều trị tối ưu, phù hợp với từng cá thể ngay từ giai đoạn sớm nhất. Việc tiếp cận sớm, tuân thủ điều trị, theo dõi sát sao và phối hợp đa chuyên khoa chính là chìa khóa để chiến thắng căn bệnh này.
BS. Nguyễn Văn Biên (Thọ Xuân Đường)




.gif)